Lorsque la MAT frappe - Chaque seconde compte
Repérer rapidement la cause sous-jacente de la MAT est essentiel à l'amélioration de l’état de santé du patient
Les patients atteints de MAT présentent la triade clinique de signes et de symptômes suivante :
ET au moins un des symptômes suivants :

Lisez l’article de McFarlane PA, et al. Making the Correct Diagnosis in Thrombotic Microangiopathy: A Narrative Review.
La MAT est un symptôme et non un diagnostic. Les MAT présentent parfois un même tableau clinique malgré une cause sous-jacente différente. Il est donc crucial de trouver la cause afin d’amorcer rapidement le traitement approprié2,3.
D’après McFarlane PA, et al. Can J Kidney Health Dis. 2021;8:20543581211008707.
CIVD : coagulation intravasculaire disséminée; DGKE : diacylglycérol kinase epsilon; FHC : facteur H du complément; GCSH : greffe de cellules souches hématopoïétiques; INF2 : inverted formin-2 (formine inversée 2); MAT : microangiopathie thrombotique; PTT : purpura thrombocytopénique thrombotique; SHU : syndrome hémolytique et urémique; SHUa : syndrome hémolytique et urémique atypique; SHU-STEC : syndrome hémolytique et urémique associé à Escherichia coli producteur de shigatoxines
* Formes de MAT touchant principalement les enfants.
CIVD : coagulation intravasculaire disséminée; DGKE : diacylglycérol kinase epsilon; FHC : facteur H du complément; GCSH : greffe de cellules souches hématopoïétiques; INF2 : inverted formin-2 (formine inversée 2); MAT : microangiopathie thrombotique; PTT : purpura thrombocytopénique thrombotique; SHU : syndrome hémolytique et urémique; SHUa : syndrome hémolytique et urémique atypique; SHU-STEC : syndrome hémolytique et urémique associé à Escherichia coli producteur de shigatoxines
* Formes de MAT touchant principalement les enfants.
Faites passer rapidement les tests importants, comme le test ADAMTS13 et le dépistage des shigatoxines, pour faire la distinction entre le SHUa, le SHU-STEC et le PTT3
- Un score PLASMIC de 0 à 4 peut être utile pour écarter le PTT5
- La probabilité de présenter un PTT est moindre chez un patient atteint de MAT dont le rapport PU/CU est ≥ 1,5 g/g6
- Un nombre de plaquettes > 30 × 109/L ou un taux de créatinine sérique > 1,7 à 2,3 mg/dL élimine presque un diagnostic de carence grave en ADAMTS13 (PTT)1.
Le PTT, le SHU-STEC et le SHUa sont déterminés par des processus physiopathologiques distincts et requièrent des objectifs de prise en charge différents
Bien qu’il n’existe aucun test qui permette à lui seul de poser rapidement un diagnostic définitif de SHUa, le SHUa doit être soupçonné en présence d’une MAT3 :
- Activité au moins partiellement préservée d’ADAMTS13 et absence d’une affection concomitante ou d’une exposition à un médicament pouvant déclencher une MAT, ou
- Si la MAT ne diminue pas malgré le traitement adéquat d’une affection concomitante
- Un résultat négatif au dépistage des shigatoxines élimine la possibilité d’un SHU-STEC
En présence du SHUa, une activation anarchique du complément terminal provoque une MAT, entraînant des lésions progressives aux organes vitaux ainsi qu’un décès prématuré2,3.
Les déclencheurs sont des affections qui peuvent activer le complément et révéler un SHUa. Il est impératif de traiter les déclencheurs, mais si les signes et symptômes de la MAT ne se résorbent pas, on doit envisager un diagnostic de SHUa « démasqué ».





Les affections amplifiant le complément peuvent aider à révéler un SHUa
Recommandations pour les cas de SHUa soupçonnés aux soins intensifs2*
- Obtenir les échantillons diagnostiques appropriés.
- Utiliser les soins d’une équipe multidisciplinaire, qui comprend des néphrologues et des hématologues.
- Instaurer le traitement par plasma dans les 4 à 8 heures suivant l’admission du patient ou le diagnostic de MAT.
- Pour les patients se présentant initialement avec une MAT, passer à un inhibiteur du complément dès qu’un diagnostic de SHUa est confirmé (ADAMTS13 > 10 % et résultat négatif au dépistage du STEC);
- Pour les patients ayant des antécédents médicaux de SHUa, instaurer un traitement par inhibiteur du complément dès l’admission aux soins intensifs.
- Surveillance attentive aux soins intensifs – une dysfonction d’organe peut survenir ou s’aggraver jusqu’à la rémission.
- Compte tenu du risque accru d’infection à Neisseria meningitidis avec le traitement par inhibiteur du complément, les patients doivent se faire vacciner contre les sérotypes A, C, Y et W135 et le sous-type B deux semaines avant l’instauration du traitement par inhibiteur du complément. Lorsqu’un traitement par inhibiteur du complément est amorcé chez des personnes non vaccinées, administrer des antibiotiques en prophylaxie jusqu’à au moins 2 semaines après la vaccination contre Neisseria meningitidis.
* Patients adultes atteints de SHUa
Sans un traitement adéquat, le SHUa est associé à un degré élevé de morbidité et de mortalité7
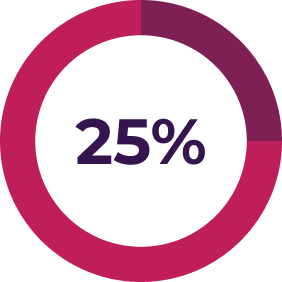
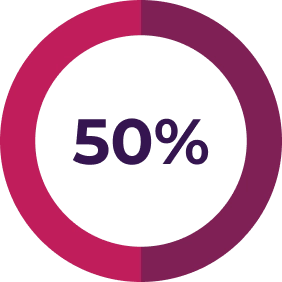
L’échange plasmatique / la perfusion de plasma ne suffit pas7
Les patients atteints du SHUa qui reçoivent un traitement par échange plasmatique / perfusion de plasma obtiennent de piètres résultats – jusqu’à 56 % des adultes voient la maladie évoluer vers une insuffisance rénale terminale ou meurent dans l’année suivant le traitement8, et cette proportion peut atteindre 77 % dans les 3 années suivant le traitement9
- Si la présence d’une MAT et d’un SHUa est soupçonnée, faites appel à une équipe multidisciplinaire de spécialistes, qui comprend des hématologues, dans le processus diagnostique
- Suivez le processus de diagnostic différentiel pour en arriver à un diagnostic
Le traitement de prédilection du SHUa est l’inhibition du complément3

Une intervention clinique précoce réduit le risque d’atteinte irréversible aux organes et de complications potentiellement mortelles1,2
ADAMTS13 : désintégrine et métalloprotéase au domaine thrombospondine de type 1, 13e membre; MAT : microangiopathie thrombotique; PTT : purpura thrombocytopénique thrombotique; PU/CU : rapport protéinurie/créatininurie; SHUa : syndrome hémolytique et urémique atypique; SHU-STEC : syndrome hémolytique et urémique associé à Escherichia coli producteur de shigatoxines; STEC : Escherichia coli producteur de shigatoxines